生体分子から人工材料へ、医療機器の進歩
|
心筋梗塞の治療では、医師が患者の心臓を一旦止め、血管のバイパス手術を行う。その際、心臓と肺の代わりをするのが人工心肺である。非常に優れた医療機器だが、ネックもある。素材が汎用材料で作られているため、患者の血液が接触すると異物反応が起こり、血栓ができて正常に機能しなくなるリスクだ。田中さん達はこの解決のため、機器の骨格を汎用のエンプラや金属で組み立て、血液が接触する表面には合成高分子(PMEA:poly(2-methoxyethyl acrylate))で処理をし、血栓形成を抑制した。機器内面をコーティングすることで、生体に親和性があるよう、言わば擬装をする。さかのぼれば1990年代には、豚や牛から摂取した生体分子を人工臓器部材の表面処理に使用していた。生体分子は、滅菌やロット管理の煩雑さもあるが、人工材料より生体親和性が高く、メーカーは難しい生産プロセスを経てでもこうした態勢を堅持していた。ところが2000年代に入り、狂牛病の問題が発生。動物由来の生体分子がヒトに対して悪影響を及ぼす実例を目の当たりにし、特に血液の凝固を防ぐ目的で普及していた「ヘパリン」が使用できなくなった。反面、人工材料は高品質化し、生体分子と同等以上の性能を持つ素材が次々と製品化されていく。

人工心肺:内部の中空糸は高分子素材。PMEAコーティングで血栓ができにくく、長期間使える。 |
|
異物認識性を左右する「接触界面」
|
田中さんのチームは、PMEAを活用して人工心肺を完成。2000年に製品として上市を成し遂げ、その後、世界シェアNo.1を維持している。その一方、本来は異物の人工材料が、なぜ高い生体親和性や良好なデータを示すのか、長年分からないままだった。「メカニズムを現場の医師に話せないようでは、現実的な売上拡大に繋がらない。また、根本的な仕組みの解明が、より良い材料の設計や、他の産業分野へ波及する技術を生むのでは」、と考えた田中さんは、さらに生体親和性発現機構の研究を進めた。医療機器の部材表面に患者の血液が接触したとき、臨床評価によるデータでは、素材の異物性が高いほど、血中の細胞の抵抗力が活性化する。数値が悪ければ製品化もできないが、“なぜ材料によって異物認識性に差が出るのか”がポイントである。注目したのは、部材の「接触界面」の状況だった。これまでの分析からは、まず小さなタンパク質が吸着し、その後、細胞が接着することは分かっていた。しかし、それだけではメカニズムの完全な解明には至らず、要因は別にあると考えた。そして、機器が血液にさらされる状況を時系列で追ってみて、思い当たったのが「水」だった。
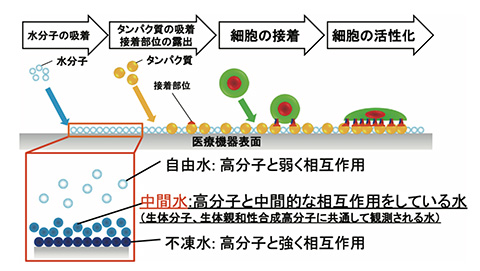
材料-生体成分の接触界面における水分子の役割
合成高分子が生体に接触すると水分子が表面に吸着。接触界面には、高分子に強く作用する不凍水、弱く作用する自由水、そして中間水が形成される。この中間水が生体親和性の発現に大きく関係する。
|
|
世界初の「中間水コンセプト」を確立
|
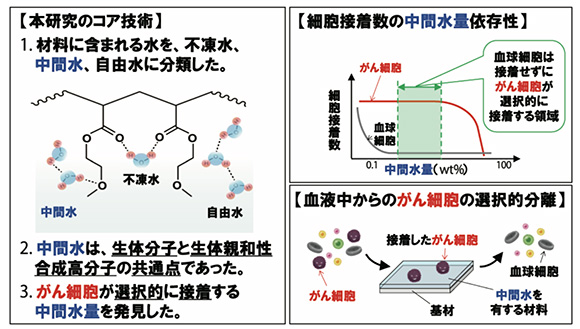
医療機器は滅菌して出荷され、病院への搬入当初は乾燥状態だが、現場で使われる際には患者の生体や血液が接触してウェットになる。最初に起こるイベントは水分子の吸着で、次いでタンパク質や細胞が接着する。機器の部材表面と生体が接触した際、形成される水の状態は3種類。強く水素結合した不凍水、逆に弱く結合した自由水、さらにその2種類の間の性質を示す中間水だ。そこで、製品化できたものとそうでない材料群に分け、実使用に近い条件下で生成される水の分類を試みた。すると、生体親和性が高い材料ほど、共通して多くの中間水が形成されることが判明した。臨床試験でも、「製品化レベルの人工素材には中間水ができる」「生物を構成する生体分子には中間水が多く生成される」ことが裏付けされた。こうして、生体親和性の発現に大きな影響を与え、新規材料のスクリーニングに貢献する世界初の「中間水コンセプト」が確立された。
|